- Taxonomie
Flusskrebse tragen sprichwörtlich ein Geheimnis mit sich, das sich einem nur bei genauer Beobachtung eröffnet. Sie haben sich koevolutiv mit wurmförmigen Organismen vergesellschaftet, die ihr gesamtes Leben auf den Flusskrebsen verbringen. Dabei handelt es sich um die sog. Krebsegel (Branchiobdellida), die innerhalb der Ringelwürmer (Annelida) zu den Gürtelwürmern (Clitellata) zählen. Bis dato wurden weltweit rund 140 verschiedene Arten und 22 Gattungen beschrieben, welche in Nord- und Mittelamerika, Europa und Asien vorkommen (Gelder und Williams, 2015). Mit dem Vorkommen von einer einzigen Gattung (Branchiobdella) mit sieben Arten, weist Europa eine verhältnismäßige geringe Diversität auf (Subchev, 2014; Gelder und Williams, 2015).
- Körperbau/Erkennungsmerkmale:
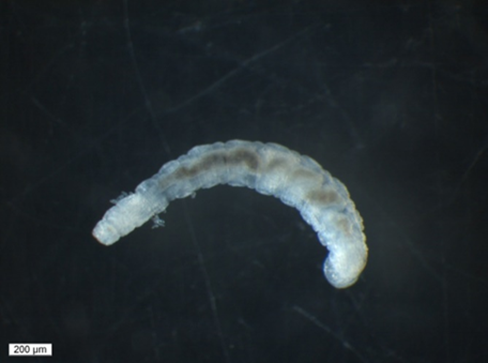
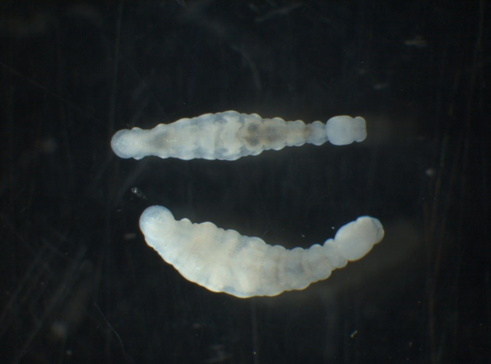
Der unpigmentierte Körper ist deutlich in Kopf, Mittelkörper und die saugnapfpfähnliche Endhaftscheibe gegliedert und besteht aus 15 Somiten. Der Kopf ist augenlos und besteht aus 4 Somiten. Die Mittelkörpersomite verteilen sich auf die Somite V bis XIV und die kaudale Haftscheibe befindet sich am letzten (XV) Somit. Der hochentwickelte Kopf trägt eine scharf abgegrenzte Mundlippe, die keine Saugnapffunktion bei der Fortbewegung übernimmt. Im Kopf befindet sich ein muskulöser Pharynx, der bei einigen Arten kranial mit einem Papillenkranz besetzt ist, dahinter ein Paar dorsoventraler Kiefer. Neben äußeren Unterscheidungsmerkmalen ist auch die Form der Kiefer artspezifisch.
Die Fortbewegung erfolgt über egelartiges Gehen. Am ventralen Bereich hinter dem Peristomium (Mundlippe) befindet sich das vordere Haftfeld, der saugnapfähnliche Somit XV stellt die hintere Haftscheibe dar (Nesemann, 1994).
- Ko-Existenz:
Die Existenz dieser Krebsegel ist unmittelbar an die Flusskrebse gebunden. Zwar wurde beobachtet, dass sie eine gewisse Zeit auch ohne ihren Wirt überleben (McManus, 1960), jedoch weist vieles darauf hin, dass sie sich ausschließlich auf ihren Wirten fortpflanzen. Dementsprechend erfolgt auch nur eine Eiablage auf dem Panzer der Flusskrebse (Young, 1966; Creed et al., 2015). Damit stellen Flusskrebse in gewisser Weise einen Kleinstlebensraum (ein Mikrohabitat) für diese Wirbellosen dar (Gelder und Williams, 2015).
Studien haben Hinweise darauf ergeben, dass große Flusskrebs-Individuen im Allgemeinen eine höhere Abundanz an Krebsegeln aufweisen. Dies dürfte nicht nur mit der größeren Körperoberfläche zusammenhängen, sondern auch mit der Tatsache, dass sich adulte Krebse weniger oft häuten. Das längere Überdauern derselben Körperoberfläche scheint damit das Egelvorkommen zu begünstigen (Scalici et al., 2010). Auf größeren Krebs-Individuen der nordamerikanischen Art Cambarus sciotensis wurde darüber hinaus auch eine höhere Arten-Diversität sowie eine größere Körpergröße der Krebsegel festgestellt (Skelton et al., 2016).
Die Krebsegel haben eine epizoische Lebensweise, d.h. sie halten sich auf der Körperoberfläche ihres tierischen Wirtsorganismus auf. Die muskulöse Haftscheibe am Körperende hilft ihnen dabei, trotz der Strömung im Fließgewässer nicht von der Körperoberfläche weggespült zu werden. Wurde anfangs angenommen, dass es sich bei Branchiobdelliden um Parasiten der Flusskrebse handelt (Holt, 1965; Grabda und Wierzbicka, 1969), haben zwischenzeitliche Studien eine weit komplexere Beziehung offenbart. So wird heute davon ausgegangen, dass die Krebsegel für ihre Wirte im Allgemeinen von Vorteil sind, da sie diese durch das Abgrasen des Biofilms (Detritus, Algen, Ciliaten, kleine Wirbellose etc.) auf ihrem Körper reinigen (Brown et al., 2002). Davon dürften auch die Flusskrebs-Eier profitieren, welche von den Weibchen außen an der Unterseite des Abdomens getragen werden (Scalici et al., 2010). Dennoch, während bei einer mittleren Krebsegel-Dichte eine positive Wirkung nachgewiesen werden konnte, zeigte sich, dass die Egel bei sehr hohen Dichten auch Kiemengewebe des Wirtstieres nicht verschmähten (Lee et al., 2009; Brown et al., 2012). Schließlich dürfte das Verhalten der Flusskrebs-Individuen einen gewissen Einfluss auf das Vorkommen ihrer Bewohner haben. So wird vermutet, dass gerade kleinere Flusskrebs-Individuen bei erhöhten Egel-Dichten durch bestimmte Bewegungen versuchen, Egel aktiv zu entfernen (Brown et al., 2002).
Das Vorkommen mehrerer Krebsegel-Arten auf einem einzelnen Flusskrebs-Individuum ist keine Seltenheit (Gelder und Williams, 2015). In Europa beispielsweise wurden bis dato bis zu vier gleichzeitig vorkommende Arten beobachtet (Klobucar et al., 2006; Füreder et al., 2009; Rimcheska et al., 2014; Berger und Fürder, 2017), in Nordamerika gar bis zu sechs Arten (Gelder and Williams, 2011).
Interessanterweise wurden trotz dieser Ko-Existenzen bis jetzt nur wenige Hinweise für relevante Interaktionen zwischen Individuen verschiedener gleichzeitig vorkommender Krebs-Egel-Arten gefunden (Gelder and Williams, 2015). Klar ist, dass sie sich den gemeinsamen „Lebensraum Flusskrebs“ teilen. Darüber hinaus wurde beobachtet, wie vereinzelt Individuen gegenüber anderen Individuen (einer anderen Art) als Fressfeinde auftreten. Insofern ist zumindest zu einem gewissen Grad von einer Konkurrenz zwischen den verschiedenen Arten auszugehen. Und dennoch, es gibt keine Hinweise dafür, dass eine Egelart eine andere völlig verdrängt. Dies könnte insbesondere damit zu erklären sein, dass Art-spezifische Aufenthaltsbereiche auf dem Flusskrebs bewohnt werden (Nesemann, 1994; Berger und Füreder, 2017), die als ökologische Mikronischen angesehen werden können.
- Geographische Verbreitung:
Auf Grund der Tatsache, dass Branchiobedlliden ausschließlich Flusskrebsen vorkommen, ist deren geographische Verbreitung unmittelbar an jene ihrer Wirte, der Flusskrebse, geknüpft. Umgekehrt, könnten regional unterschiedliche Krebs-Egelpopulationen auf Flusskrebsen unter Umständen Hinweise auf historische Wanderrouten der Krebse geben. So wurde in einer Studie im deutschsprachigen Raum die Egelart B. balcanica zwar im Donau-Einzugsbiet gefunden, nicht aber im Rhein-Einzugsgebiet. Dies könne darauf hindeuten, dass die Rekolonisierung dieser beiden großen Einzugsgebiete nach der letzten Eiszeit durch unterschiedliche phylogenetische Krebs-Populationen erfolgt ist, die sich noch nicht wieder vermischt haben (Berger und Füreder, 2017).
Zu einzelnen Arten im deutschprachigen Raum:
- B. parasita
B. parasita (s. Abb. 1a) dürfte die größte hierzulande vorkommende Art mit einer Länge bis zu 10 mm sein. Der große Kopf weist eine deutlich abgesetzte Lippe auf. Ober- und Unterkiefer sind dreieckig und haben an den schrägen Kanten feine Zähne. Diese Art hält sich bevorzugt auf dem Carapax und dem Pleon des Krebses auf. Dorsaler und ventraler Kiefer sind etwa gleich groß, triangular mit mehreren kleinen Zähnen an der Spitze (Abb. 1b) (Nesemann, 1994).
 (Abb 1a)
(Abb 1a) (Abb 1b)
(Abb 1b)- B. hexadonta
B. hexadonta (s. Abb. 2a) erreicht eine Maximallänge von 4-6 mm und ist äußerlich erkennbar an einer 3-Teilung des Kopfes, wobei der vorderste Abschnitt die abgeschnürte Lippe ist. Ihr Rumpf ist zylindrisch (nicht abgeflacht). Der Oberkiefer trägt meist 6 Zähne, von denen die äußeren, am höchsten sind (namengebende Eigenschaft), der Unterkiefer dagegen nur 5 (Abb. 2b). Diese Art dürfte sich v.a. in Gelenksspalten und in der Kiemenhöhle des Krebses aufhalten (Pop, 1965; Grabda und Wierzbicka, 1969; Berger und Füreder, 2017).
 (Abb 2a)
(Abb 2a)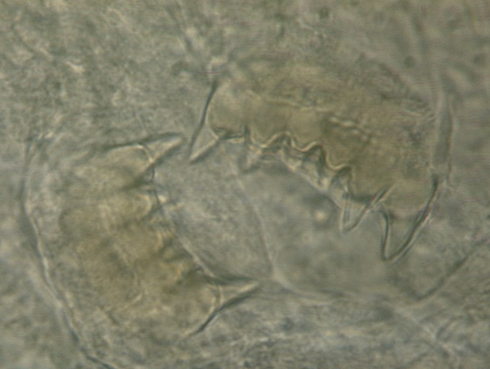 (Abb 2b)
(Abb 2b)- B. pentodonta
B. pentodonta Individuen (Abb. 3a) werden kaum größer als 4,5 mm. Der Kopf ist eiförmig mit einer deutlich abgesetzten Mundlippe. Der Mittelkörper ist abgeflacht mit zunehmender Breite bis zum Somit X (Nesemann, 1994). Diese Art wird am häufigsten auf den Scheren der Flusskrebse gefunden (Neubert und Nesemann, 1999; Berger und Füreder, 2017). Dorsaler und ventraler Kiefer (Abb. 3b) sind etwa gleich groß, ähnlich B. balcanica mit etwa 5 (selten 6-7) Zähnen, wovon der mittlere am höchsten ist.
 (Abb 3a)
(Abb 3a)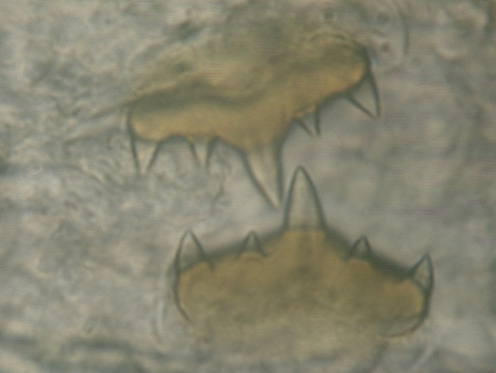 (Abb 3b)
(Abb 3b)- B. balcanica
B. balcanica (Abb. 4a) erreicht bei voller Streckung eine Länge von ca. 4 bis 5 mm. Der Kopf ist länglich zylindrisch mit einer deutlich abgesetzten Mundlippe. Die Somite VII bis XII sind stark verbreitert und abgeflacht (Nesemann, 1994). Im Vergleich zu B. pentodonta sind diese Somite gegenüber dem VI. Somit deutlicher abgesetzt. Dorsaler und ventrale Kiefer (Abb. 4b) etwa gleich groß in der Regel mit fünf Zähnen, von denen der mittlere am höchsten ist.
 (Abb 4a)
(Abb 4a)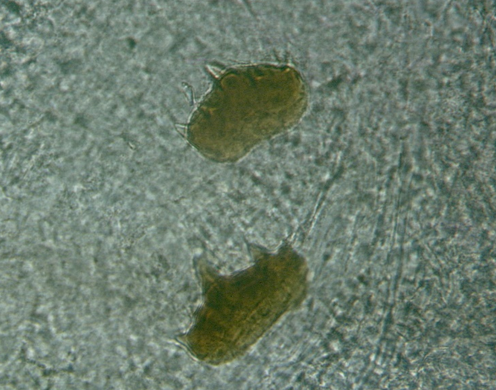 (Abb 4b)
(Abb 4b)- Verwendete Literatur:
Berger C, Füreder L. 2017. Annelid symbiont assemblage and European stone crayfish - a deterministic relationship with implications for conservation management. Knowl.Manag. Aquat. Ecosyst. 2017: 418, 50.
Brown BL, Creed RP, Dobson WE. 2002. Branchiobdellid annelids and their crayfish hosts: are they engaged in a cleaning symbiosis? Oecologia 132: 250–255.
Brown BL, Creed RP, Skelton J, Rollins MA, Farrell KJ. 2012. The fine line between mutualism and parasitism: complex effects in a cleaning symbiosis demonstrated by multiple field experiments. Oecologia 170: 199–207.
Creed RPJ, Lomonaco D, Thomas MJ, Meeks A, Brown BL. 2015. Reproductive dependence of a Branchiobdellidan annelid on its crayfish host: confirmation of a mutualism. Crustaceana 88: 385–396.
Füreder L, Summerer M, Brandstätter A. 2009. Phylogeny and species composition of five European species of Branchiobdella (Annelida: Clitellata: Branchiobdellida) reflect the biogeographic history of three endangered crayfish species. J Zool 279: 164–172.
Gelder SR, Williams BW. 2011. First distributional study of branchiobdellida (Annelida: Clitellata) in the Smoky Mountains National Park, North Carolina and Tennessee, USA, with a redescription of Cambarincola holostomus Hoffman, 1963. Southeast N 10: 211–220.
Gelder SR, Williams BW. 2015. Clitellata: Branchiobdellida. In: Thorp JH, Rogers DC, eds. Ecology and general biology: Thorp and Covich’s freshwater invertebrates. London, UK: Academic Press, pp. 551–563.
Grabda E, Wierzbicka J. 1969. The problem of parasitism of the species of the genus Branchiobdella Odier 1823. Pol Arch Hydrobiol 16: 93–104.
Holt PC. 1965. The systematic position of the Branchiobdellidae (Annelida: Clitellata). Syst Zool 14: 25–32.
Klobučar GIV, Maguire I, Gottstein S, Gelder SR. 2006. Occurrence of Branchiobdellidae (Annelida: Clitellata) on freshwater crayfish in Croatia. Int J Limnol 42: 251–260.
Lee JH, Kim TW, Choe JC. 2009. Commensalism or mutualism: conditional outcomes in a branchiobdellid-crayfish symbiosis. Oecologia 159: 217–224.
McManus LR. 1960. Some ecological studies of the Branchiobdellidae (Oligochaeta). Trans Am Microsc Soc 79: 420–428.
Nesemann H. 1994. Die Krebsegel im Gebiet der Oberen Donau (Österreich, Deutschland) mit Bestimmungsschlüssel zu den europäischen Arten (Clitellata, Branchiobdellida). Lauterbornia 19: 79–93.
Neubert E, Nesemann H. 1999. Annelida, Clitellata. Branchiobdellida, Acanthobdellida, Hirudinea. Heidelberg/Berlin: Spektrum Akademischer Verlag GmbH, 170 p.
Pop V. 1965. Systematische Revision der europäischen Branchiobdelliden (Oligochaeta). Zool Jahrb 92: 219–238.
Biljana Rimcheska, Galia Georgieva, Valentina Slavevska-Stamenković, Stoe Smiljkov, Yordan Uzunov, Danijela Mitić-Kopanja. 2014. New Data about Occurrence of Epibiotic Branchibdellid (Annelida: Branchiobdellea) Species on the Stone Crayfish Austropotamobius torrentium (Schrank, 1803) in the Republic of Macedonia. Acta .ool. bulg. 66(2): 261-263.
Scalici M, Di Giulio A, Gibertini G. 2010. Biological and morphological aspects of Branchiobdella italica (Annelida: Clitellata) in a native crayfish population of central Italy. Ital J Zool 77: 410–418.
Skelton J, Doak S, Leonard M, Creed RP, Brown BL. 2016. The rules for symbiont community assembly change along a mutualismparasitism continuum. J Anim Ecol 85: 843–853.
Subchev MA. 2014. The genus Branchiobdella Odier, 1823 (Annelida, Clitellata, Branchiobdellida): a review of its European species. Acta Zool Bulg 66: 5–20.
Young W. 1966. Ecological studies of the Branchiobdellidae (Oligochaeta). Ecology 47: 571–578.
